
Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
Undersøgelsen understreger behovet for celletype-specifikke behandlinger af hiv
Sidst revideret: 02.07.2025
Forskere ved University of Illinois har vist vigtigheden af at målrette specifikke celletyper i behandlingen af HIV. Deres undersøgelse, der er offentliggjort i tidsskriftet Proceedings of the National Academy of Sciences, er en af de første til at undersøge de differentielle eller celletypespecifikke effekter af HIV-latensmodulation på myeloide celler, en type immuncelle, der produceres i knoglemarven.
En af de største hindringer for at eliminere HIV-infektion er håndtering af latenstid, eller den periode, hvor en inficeret celle ligger i dvale og ikke kan producere virus. Latente HIV-celler ophobes i kroppen på steder kendt som reservoirer. Latente reservoirer er problematiske, fordi de kan begynde at producere virus når som helst.
Fuldstændig udryddelse af sygdommen ville kræve fjernelse af alle latente celler fra kroppen eller permanent resistens over for aktiveringsstimuli. Reaktivering kan dog udløses af en række faktorer, herunder signaler, der styrer myeloidcelledifferentiering.
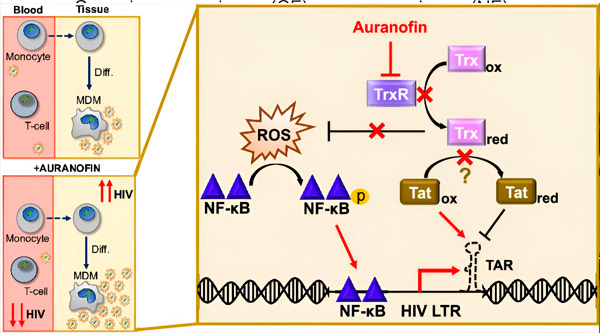
Regulering af HIV-latens i monocyt-afledte makrofager (MDM'er) kan udgøre en risiko for virusspredning. Differentiering af monocytter til makrofager kan udløse HIV-reaktivering, hvilket potentielt fremmer virusspredning i væv (øverst til venstre). En klinisk kandidat, Auranofin, reducerer viralt DNA i blod og fremmer HIV-latens i T-celler og monocytter, men forårsager HIV-reaktivering i MDM'er (nederst til venstre). I MDM'er antager vi, at hæmning af TrxR af Auranofin fører til akkumulering af reaktive iltarter (ROS), hvilket inducerer NF-κB-aktivering og aktivering af HIV LTR-promotoren (højre). Hæmning af TrxR reducerer potentielt substratreduktion, hvilket tillader Tat-proteinet at forblive fortrinsvis oxideret, hvor det kan binde til TAR og initiere HIV-transkription. Kilde: Proceedings of the National Academy of Sciences (2024). DOI: 10.1073/pnas.2313823121
I årevis har forskning i HIV-kurering centreret sig om to tilgange kendt som "shock and kill" og "block and lock". Førstnævnte virker i kombination med antiretroviral terapi for at aktivere latent inficerede celler og dræbe dem gennem apoptose eller programmeret celledød, mens sidstnævnte tvinger inficerede celler ind i en dyb latent tilstand, hvorfra de ikke kan genaktiveres på egen hånd.
Forskning omkring disse teknikker har traditionelt fokuseret på en type hvide blodlegemer kaldet T-celler, som er det primære mål for HIV-infektion. Latente reservoirer består dog af mere end blot T-celler; faktisk indeholder de snesevis af forskellige celletyper, hver med sine egne unikke mønstre af HIV-genekspression.
"Der er en enorm diversitet af celler, selv inden for en enkelt cellelinje," sagde Collin Kieffer, adjunkt i mikrobiologi og forfatter til artiklen. "Variabiliteten af responsen i disse reservoirer stiger med hver ny celletype."
Alexandra Blanco, en kandidatstuderende i Kieffers laboratorium, ønskede at studere celletyper, der var blevet overset i traditionel HIV-forskning. Med fokus på myeloide celler skabte hun et klonbibliotek indeholdende 70 populationer af latent inficerede monocytter. Blanco analyserede derefter de klonale populationer og deres reaktioner på aktivering. Reaktionerne varierede meget, hvilket fremhæver den store diversitet inden for en enkelt celletype.
Denne observation rejste et nyt spørgsmål: Reagerer forskellige celletyper virkelig forskellige på HIV-latensbehandlinger? Deres resultater viste faktisk, at nogle HIV-latensbehandlinger kan fremme latens i T-celler og monocytter, mens de kan vende latens i makrofager.
"Ikke alle celler i kroppen er ens," sagde Kieffer. "Så det giver mening, at ikke alle inficerede celler reagerer på virussen på samme måde."
Deres artikel fremhæver behovet for, at fremtidige HIV-behandlinger tager højde for alle celletyper og hvordan hver celle kan reagere på potentielle behandlinger.
Deres resultater bygger på forskning foretaget af Roy Dar, en tidligere professor i bioingeniørvidenskab fra Illinois, hvis laboratorium studerede heterogenitet i HIV-genekspression.
"Han startede det, og vi overtog det og byggede det op til, hvor det er i dag," sagde Kieffer. "Så samarbejdet satte virkelig gang i disse resultater. Det har vendt vores laboratorium mod en ny retning, og vi er virkelig begejstrede for det."
Et yderligere og uventet fund fra Blancos analyse afslørede ændringer i cellestørrelse og -form som reaktion på infektion, hvilket tyder på, at HIV kan ændre cellemorfologien. Blancos næste mål er at identificere de biologiske mekanismer, der ligger til grund for disse fænotypiske ændringer.
Kieffer og hans laboratoriemedlemmer ser også frem til at reproducere deres resultater, som hovedsageligt blev udført i en cellelinje, i primære celler. Reproduktion af resultaterne i en mere menneskelignende model ville forbedre studiets kliniske relevans, forklarede Kieffer.
"Vi vil gerne lave større screeninger i T-celler, monocytter og makrofager for at identificere potentielle lægemidler, der kan virke på alle disse celletyper," sagde Blanco. "Vi kan muligvis finde endnu flere molekyler, der ikke opfører sig på en celletypespecifik måde."
