
Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
Kombinationsbehandling af blodkræft: Studie viser, at to lægemidler dræber kræftceller
Sidst revideret: 02.07.2025
En ny kombination af to kræftlægemidler har vist sig lovende som en fremtidig behandling af patienter med akut myeloid leukæmi (AML), en af de mest almindelige typer blodkræft. En ny undersøgelse foretaget af forskere ved WEHI (Walter and Eliza Hall Institute of Medical Research) viste, at en kombination af to eksisterende lægemidler dræbte AML-celler i laboratorietests.
Opdagelsen, der er offentliggjort i tidsskriftet Cancer Cell, kan snart føre til kliniske forsøg, hvilket giver håb for de 1.100 australiere, der diagnosticeres med AML hvert år.
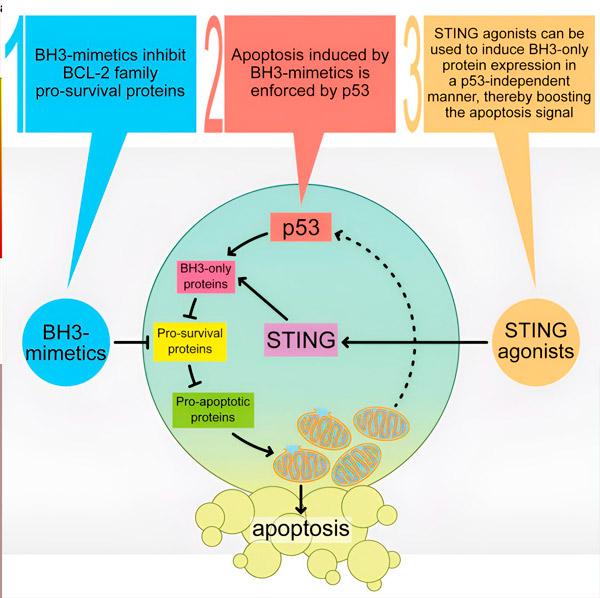
Stimulering af 'celledødsudløseren' WEHI-teamet kombinerede venetoclax, et af standardlægemidlerne til behandling af akut myeloid leukæmi, med en STING-agonist, en ny klasse af immunterapi-lægemidler. Venetoclax var baseret på en skelsættende forskningsopdagelse på WEHI.
Dr. Sarah Diepstraten, en af studiets medforfattere, sagde, at teamet undersøgte forskellige typer blodkræft, herunder kræftprøver fra AML-patienter, og behandlede dem i laboratoriet med en kombination af lægemidler, hvilket førte til imponerende resultater.
"Det er virkelig spændende, at kombinationen af venetoclax med denne nye immunterapibehandling rent faktisk kan udrydde AML," sagde Dr. Diepstraten.
P53-proteinets kritiske rolle
Kombinationsbehandlingen viste stort potentiale i AML-prøver forbundet med et muteret protein kaldet p53, en type AML, der typisk er mere aggressiv og vanskelig at behandle. P53-proteinet spiller en afgørende rolle i vores kroppe, idet det forhindrer dannelsen af kræftceller, fungerer som en beskytter og standser væksten af beskadigede eller unormale celler. Imidlertid øger p53-mutationer risikoen for at udvikle kræft betydeligt.
"For patienter med AML, som ikke oplever tilstrækkelig død af deres leukæmiceller på grund af denne mutation, forårsager kombinationen af venetoclax med en STING-agonist større drab af AML-celler end behandling med venetoclax alene," forklarer Dr. Diepstraten.
Grafisk figur. Kilde: Cancer Cell (2024). DOI: 10.1016/j.ccell.2024.04.004
STING-agonist i en ny rolle
Dette studie er det første, der bruger en STING-agonist til direkte at målrette mekanismer i kræftceller og stimulere de naturlige processer, der får dem til at dø. Tidligere er STING-agonister blevet brugt til at angribe solide tumorer ved at aktivere kroppens immunrespons.
Potentielle kliniske forsøg
Professor Andrew Wei, en af undersøgelsens ledende forfattere, sagde, at resultaterne var meget lovende, selvom yderligere forskning var nødvendig.
"Tidlige kliniske forsøg med solide tumorer har vist, at STING-agonister tolereres godt af kroppen, og disse resultater giver nyt håb for patienter med de mest resistente former for leukæmi," sagde professor Wei.
WEHI og deres kliniske partnere omsætter nu disse lovende resultater til et nyt klinisk forsøg for AML-patienter i samarbejde med den Melbourne-baserede bioteknologiske virksomhed Aculeus Therapeutics, som er ved at udvikle sin egen STING-agonist.
Aculeus Therapeutics' administrerende direktør, Dr. Mark Devlin, udtalte, at han var begejstret for potentialet i WEHIs nylige opdagelse. "Lægemiddeludvikling er et holdspil inden for videnskab. Aculeus har udviklet et lovende nyt lægemiddel, men samarbejdet med WEHI-teamene, der har en dyb forståelse af sygdomsbiologien og det kliniske landskab, vil hjælpe med at bestemme, hvordan dette lægemiddel vil blive brugt mest effektivt."
Aculeus' STING-agonist, ACU-0943, forventes at blive anvendt i kliniske forsøg til behandling af AML senere på året.
