
Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
Derivater af thalidomidforbindelser får resistente kræftceller til at dø
Sidst revideret: 02.07.2025
En undersøgelse foretaget af Goethe Universitet i Frankfurt peger på muligheden for, at thalidomidderivater potentielt kan bruges til behandling af kræft. Thalidomid blev solgt som en sovepille i 1950'erne. Det blev senere berygtet for at forårsage alvorlige fødselsdefekter i de tidlige stadier af graviditeten.
Molekylet er også kendt for at markere proteiner i cellen til destruktion. Som en del af den aktuelle undersøgelse har forskere skabt derivater af thalidomid. De var i stand til at vise, at disse stoffer påvirker ødelæggelsen af proteiner, der er ansvarlige for kræftcellers overlevelse.
Måske har intet andet molekyle haft en så turbulent fortid som thalidomid. Det var hovedingrediensen i et lægemiddel, der blev godkendt i mange lande i 1950'erne som beroligende middel og sovepille. Men det blev hurtigt klart, at gravide kvinder, der tog thalidomid, ofte fødte babyer med alvorlige deformiteter.
I de seneste årtier har medicinen dog igen sat store forhåbninger til det. Studier har blandt andet vist, at det hæmmer væksten af blodkar og derfor potentielt er egnet til at afskære tumorer fra deres næringsmedium. Det har også vist sig at være meget effektivt i behandlingen af multipelt myelom, maligne tumorer i knoglemarven.
"Vi ved nu, at thalidomid kan kaldes en 'molekylær lim'," forklarer Dr. Xinglai Cheng fra Institut for Farmaceutisk Kemi ved Goethe Universitet i Frankfurt. "Det betyder, at det er i stand til at gribe to proteiner og forbinde dem."
Dette er særligt interessant, fordi et af disse proteiner er en slags "mærkningsmaskine": den hæfter en utvetydig "AFFALD"-etiket til et andet protein.
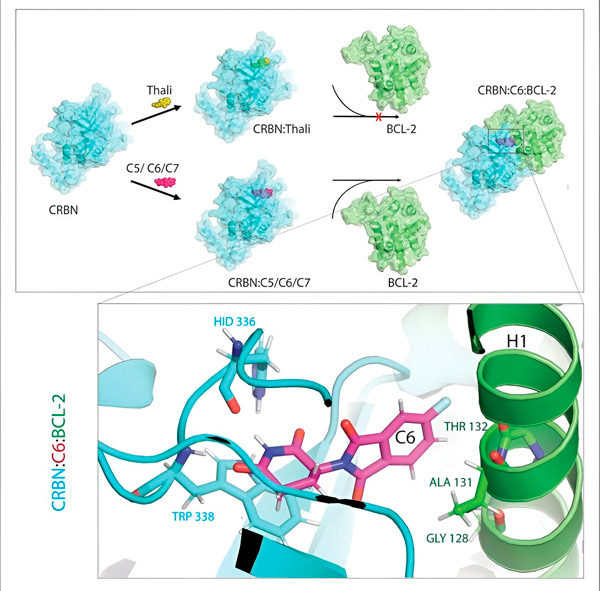
Thalidomidderivaterne C5, C6 og C7 ændrer CRBN, "mærkningsmaskinen", så den kan binde sig til BCL-2. På denne måde markeres BCL-2-molekylet til nedbrydning – en mulig ny strategi til at bekæmpe kræft. Forfatter: Dr. Xinglai Cheng.
Cellens affaldssystem genkender dette mærke: Det griber fat i det mærkede proteinmolekyle og makulerer det. "Denne mekanisme forklarer de forskellige virkninger af thalidomid," siger Cheng. "Afhængigt af hvilket protein der er mærket, kan det forårsage deformiteter under embryonal udvikling eller ødelægge maligne celler."
Denne mekanisme åbner store muligheder for medicin, da kræftceller er afhængige af bestemte proteiner for at overleve. Hvis de systematisk kunne målrettes og nedbrydes, kunne sygdommen måske kureres. Problemet er, at den molekylære lim er ret ejendommelig.
En af dens bindingspartnere er altid cellens mærkningsmaskine, eller i videnskabelig sprogbrug en E3-ligase kaldet CRBN. Kun meget få af de mange tusinde proteiner i kroppen kan være den anden partner – hvilke afhænger af limen.
"Så vi skabte en række thalidomidderivater," siger Cheng. "Vi testede derefter, om de havde adhæsive egenskaber, og i så fald hvilke proteiner de var effektive imod." For at gøre dette tilsatte forskerne deres derivater til alle proteinerne i den dyrkede cellelinje. De observerede derefter, hvilke af disse proteiner der blev nedbrudt i nærvær af CRBN.
"I processen identificerede vi tre derivater, der kunne mærke et cellulært protein, BCL-2, som er meget vigtigt for nedbrydning," forklarer Cheng. "BCL-2 forhindrer cellerne i at aktivere deres selvdestruktionsprogram, så hvis det ikke er der, dør cellerne."
Derfor har BCL-2 længe været et fokusområde for kræftforskning. Der findes endda et leukæmilægemiddel kaldet venetoclax, der reducerer effektiviteten af BCL-2 og dermed får muterede celler til at selvdestruere.
"I mange kræftceller er BCL-2 dog muteret. Som følge heraf hæmmer venetoclax ikke længere proteinet," siger Cheng. "Vi var i stand til at vise, at vores derivater også markerer denne muterede form for nedbrydning. Derudover simulerede vores partnere på Max Planck Institute for Biophysics interaktionen mellem thalidomidderivater og BCL-2 på en computer. Dette viste, at derivaterne binder til helt andre steder end venetoclax - et resultat, som vi senere var i stand til at bekræfte eksperimentelt."
Forskerne testede også deres forbindelser på frugtfluer med kræftceller. Overlevelsesraten for de fluer, der blev behandlet på denne måde, var betydeligt højere. Cheng advarer dog mod at have for store forhåbninger, da disse resultater stadig er grundforskning. "Selvom de viser, at de modificerede thalidomidmolekyler har et stort terapeutisk potentiale, kan vi endnu ikke sige, om de vil vise sig i praksis på et tidspunkt."
Resultaterne af undersøgelsen blev offentliggjort i tidsskriftet Cell Reports Physical Science.
