
Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
Æggestokkene
Medicinsk ekspert af artiklen
Sidst revideret: 04.07.2025

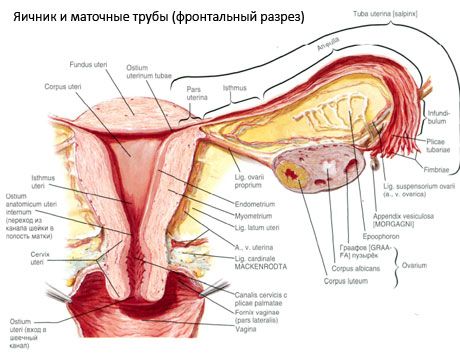
Æggestokken (ovarium; græsk oophoron) er et parret organ, en kvindelig reproduktionskirtel, der er placeret i bækkenhulen bag livmoderens brede ligament. I æggestokkene udvikles og modnes de kvindelige reproduktionsceller (æg), og der dannes kvindelige kønshormoner, som kommer ind i blodet og lymfen. Æggestokken har en oval form, noget fladtrykt i anteroposterior retning. Æggestokkens farve er lyserød. På overfladen af æggestokken hos en kvinde, der har født, er der synlige fordybninger og ar - spor af ægløsning og transformation af corpora lutea. Æggestokken vejer 5-8 g. Æggestokkens dimensioner er: længde 2,5-5,5 cm, bredde 1,5-3,0 cm, tykkelse - op til 2 cm. Æggestokken har to frie overflader: den mediale overflade (facies medialis), der vender mod bækkenhulen, delvist dækket af æggelederen, og den laterale overflade (facies lateralis), der støder op til bækkenets sidevæg, til en let udtalt fordybning - æggestokkens fossa. Denne fossa er placeret i vinklen mellem de ydre iliacakar, der er dækket af peritoneum øverst, og de uterine og obturatoriske arterier nederst. Bag æggestokken passerer urinlederen på den tilsvarende side retroperitonealt fra top til bund.
Æggestokkens overflader går over i en konveks fri (posterior) kant (margo liber), foran - i mesenterialkanten (margo mesovaricus), der er fastgjort ved hjælp af en kort fold af peritoneum (æggestokkens mesenterium) til den bageste del af livmoderligamentet. På denne forreste kant af organet er der en rillet fordybning - æggestokkens hilum (hilum ovarii), hvorigennem arterien og nerverne kommer ind i æggestokken, og venerne og lymfekarrene kommer ud. Æggestokken har også to ender: den afrundede øvre rørformede ende (extremitas tubaria), der vender mod æggelederen, og den nedre livmoderende (extremitas utenna), der er forbundet med livmoderen via æggestokkens ligament (lig. ovarii proprium). Dette ligament, i form af en rund snor på ca. 6 mm tykkelse, går fra æggestokkens livmoderende til livmoderens laterale vinkel, der er placeret mellem de to del af livmoderligamentet. Æggestokkens ligamentapparat omfatter også æggestokkens ligamentophæng (lig.suspensorium ovarii), som er en fold i bughinden, der løber fra bækkenvæggen til æggestokken og indeholder æggestokkens kar og bundter af fiberholdige fibre indeni. Æggestokken er fastgjort af et kort mesenterium (mesovarium), som er en duplikering af bughinden, der løber fra den bageste del af livmoderligamentet til æggestokkens mesenteriske kant. Æggestokkene selv er ikke dækket af bughinden. Den største æggestokkkant af æggelederen er fastgjort til æggestokkens rørformede ende. Æggestokkens topografi afhænger af livmoderens position, dens størrelse (under graviditet). Æggestokkene er meget mobile organer i bækkenhulen.
Æggestokkens kar og nerver
Blodforsyningen til æggestokkene varetages af aa. et vv. ovaricae et uterinae. Begge ovariearterier (aa. ovaricae dextra et sinistra) udgår fra aortas forreste overflade lige under nyrearterierne; den højre udgår normalt fra aorta, og den venstre fra nyrearterien. Hver ovariearterie, der vender nedad og lateralt langs den forreste overflade af psoas major-musklen, krydser ureteret foran (og afgiver forgreninger til den), de ydre iliackar, grænselinjen og går ind i bækkenhulen, hvor den er placeret her i æggestokkens ophængningsligament. I medial retning passerer ovariearterien mellem bladene på livmoderens brede ligament under æggelederen, hvor den afgiver forgreninger til den og derefter ind i æggestokkens mesenterium; den går ind i æggestokkens hilum.
A. ovarie grenene ligger i vid udstrækning anastomoser med a. uterus æggestokkenes grene. Venøs udstrømning fra æggestokkene udføres primært ind i den ovarielle venøse plexus, der er placeret i regionen af ovariehilum. Herfra passerer blodudstrømningen i to retninger: gennem uterus- og ovarievenerne. Den højre ovarievene har klapper og løber ud i den nedre hulvene. Den venstre ovarievene løber ud i den venstre nyrevene, selvom den ikke har klapper.
Lymfedrænage fra æggestokkene sker gennem lymfekarrene, især rigeligt i området omkring organporten, hvor den subovariære lymfeplexus udskilles. Derefter udledes lymfen langs ovariernes lymfekar til de paraaorta lymfeknuder.
Innervation af æggestokkene
Sympatisk - leveret af postganglionære fibre fra cøliaki- (solar-), mesenterial-superior- og hypogastriske plexus; parasympatisk - af de viscerale sakralnerver.
Strukturen af æggestokken
Ovariets overflade er dækket af et enkeltlags germinalt epitel. Nedenunder ligger et tæt proteinlag af bindevæv (tunica albuginea). Ovariets bindevæv danner sit stroma (stroma ovarii), der er rig på elastiske fibre. Ovariets substans, dets parenkym, er opdelt i et ydre og et indre lag. Det indre lag, der er placeret i midten af ovariet, tættere på dens port, kaldes medulla (medulla ovarii). I dette lag, i det løst bindevæv, er der talrige blod- og lymfekar og nerver. Ovariets ydre lag - cortex (cortex ovarii) - er tættere. Det indeholder en masse bindevæv, hvori de modne primære ovariefollikler (folliculi ovarici primarii), sekundære (vesikulære) follikler (folliculi ovarici secundarii, s.vesiculosi) samt modne follikler, Graafske follikler (folliculi ovarici maturis), samt gule og atretiske legemer er placeret.
Hver follikel indeholder et kvindeligt reproduktivt æg, eller en oocyt (ovocytus). Ægget er op til 150 µm i diameter, rundt, indeholder en cellekerne, en stor mængde cytoplasma, som udover cellulære organeller indeholder protein-lipidindeslutninger (æggeblomme), glykogen, som er nødvendige for æggets næring. Ægget bruger normalt sin forsyning af næringsstoffer inden for 12-24 timer efter ægløsning. Hvis befrugtning ikke finder sted, dør ægget.
Det menneskelige æg har to membraner, der dækker det. Indeni er cytolemmaet, som er æggets cytoplasmatiske membran. Uden for cytolemmaet er der et lag af såkaldte follikulære celler, som beskytter ægget og udfører en hormondannende funktion - de udskiller østrogener.
Livmoderens, æggeledernes og æggestokkenes fysiologiske position sikres af de ophængende, fikserende og støttende apparater, der forbinder bughinden, ledbåndene og bækkenvævet. Ophængningsapparatet er repræsenteret af parrede formationer, det omfatter livmoderens runde og brede ledbånd, æggestokkenes egentlige ledbånd og ophængende ledbånd. Livmoderens brede ledbånd, æggestokkenes egentlige og ophængende ledbånd holder livmoderen i midterpositionen. De runde ledbånd trækker livmoderfundus fremad og giver dens fysiologiske hældning.
Fikseringsapparatet (forankringsapparatet) sikrer livmoderens position i midten af bækkenet og gør det praktisk talt umuligt for den at forskyde sig til siderne, frem og tilbage. Men da det ligamentøse apparat udgår fra livmoderen i dens nedre del, er livmoderen mulig med hældninger i forskellige retninger. Fikseringsapparatet omfatter ledbånd placeret i bækkenets løse væv og strækker sig fra livmoderens nedre del til bækkenets laterale, forreste og bageste vægge: sakromagiske, kardinale, uterovesikale og vesicopubiske ledbånd.
Ud over mesovariumet skelnes følgende ovarieligamenter:
- Ovariets ophængsligament, tidligere betegnet som det infundibulopelviske ligament. Det er en fold i peritoneum med blodkar (a. et v. ovarica) og lymfekar og nerver fra æggestokken, der passerer igennem den, strakt mellem bækkenets laterale væg, lumbalfascien (i det område, hvor arteria iliac communis deles i en ydre og en indre) og den øvre (tubale) ende af æggestokken;
- Æggestokkens egenligament passerer mellem bladene på det brede livmoderligament, tættere på det bageste blad, og forbinder æggestokkens nederste ende med livmoderens laterale kant. Æggestokkens egenligament er fastgjort til livmoderen mellem begyndelsen af æggelederen og det runde ligament, bag og over sidstnævnte. I ligamentets tykkelse passerer rr. ovarii, som er de terminale grene af livmoderarterien;
- Appendicular-ovarieligament Ligamentet strækker sig fra blindtarmenes mesenterium til den højre æggestok eller det brede ligament i livmoderen i form af en fold i peritoneum. Ligamentet er inkonstant og observeres hos 1/2-1/3 af kvinderne.
Støtteapparatet er repræsenteret af bækkenbundens muskler og fascia, opdelt i nedre, mellemste og øvre (indre) lag.
Det kraftigste er det øvre (indre) muskellag, repræsenteret af den parrede muskel, der løfter anus. Det består af muskelbundter, der strækker sig fra halebenet til bækkenbenene i tre retninger (pubococcygeus, iliococcygeus og ischiococcygeus). Dette muskellag kaldes også bækkenmembranen.
Det midterste muskellag er placeret mellem symfysen, skambenet og sædebenet. Det midterste muskellag - det urogenitale diafragma - optager den forreste halvdel af bækkenudløbet, hvorigennem urinrøret og vaginaen passerer. I den forreste del mellem dens lag er der muskelbundter, der danner urinrørets ydre lukkemuskel, i den bageste del er der muskelbundter, der går i tværgående retning - den dybe tværgående muskel i perineum.
Det nedre (ydre) lag af bækkenbundsmusklerne består af overfladiske muskler, hvis form ligner tallet 8. Disse omfatter den bulbocavernøse, ischiocavernøse, eksterne anallukkemuskel og den overfladiske tværgående perinealmuskel.
Ontogenese af æggestokkene
Processen med follikelvækst og atresi begynder i 20. graviditetsuge, og ved fødslen er der op til 2 millioner ægceller tilbage i pigens æggestokke. Ved menarch falder deres antal til 300 tusind. I løbet af hele den reproduktive periode når højst 500 follikler modenhed og ægløsning. Den indledende vækst af follikler afhænger ikke af FSH-stimulering, er begrænset, og atresi opstår hurtigt. Det antages, at lokale autokrine/parakrine peptider i stedet for steroidhormoner er den primære regulator af vækst og atresi af primære follikler. Det antages, at processen med follikelvækst og atresi ikke afbrydes af nogen fysiologiske processer. Denne proces fortsætter i alle aldre, inklusive den intrauterine periode og overgangsalderen, og afbrydes af graviditet, ægløsning og anovulering. Mekanismen, der udløser follikelvækst, og deres antal i hver specifik cyklus, er stadig uklar.
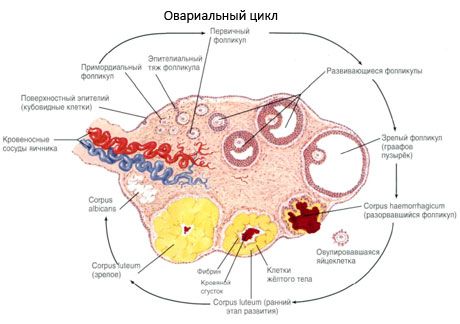
Under sin udvikling gennemgår folliklen flere udviklingsstadier. Primordiale kønsceller stammer fra endodermen i blommesækken, allantois, og migrerer til embryoets kønsdel i 5-6 uger af graviditeten. Som følge af hurtig mitotisk deling, der fortsætter fra 6-8 uger til 16-20 uger af graviditeten, dannes op til 6-7 millioner oocytter i embryoets æggestokke, omgivet af et tyndt lag granulosaceller.
Præantral follikel - oocytten er omgivet af en membran (Zona pellucida). Granulosacellerne omkring oocytten begynder at proliferere, deres vækst afhænger af gonadotropiner og korrelerer med niveauet af østrogener. Granulosaceller er målet for FSH. I det præantrale follikelstadium er granulosacellerne i stand til at syntetisere tre klasser af steroider: inducerer overvejende aktiviteten af aromatase, det vigtigste enzym, der omdanner androgener til østradiol. Det antages, at østradiol er i stand til at øge antallet af sine egne receptorer og udøver en direkte mitogen effekt på granulosaceller uafhængigt af FSH. Det betragtes som en parakrin faktor, der forstærker virkningerne af FSH, herunder aktivering af aromatiseringsprocesser.
FSH-receptorer optræder på membranerne i granulosacellerne, så snart follikelvæksten begynder. Et fald eller en stigning i FSH fører til en ændring i antallet af dets receptorer. Denne virkning af FSH moduleres af vækstfaktorer. FSH virker gennem G-proteinet, adenylatcyklasesystemet, selvom steroidogenese i folliklen hovedsageligt reguleres af FSH, er mange faktorer involveret i denne proces: ionkanaler, tyrosinkinasereceptorer, fosfolipasesystemet af sekundære budbringere.
Androgeners rolle i tidlig follikeludvikling er kompleks. Granulosaceller har androgenreceptorer. Disse er ikke kun et substrat for FSH-induceret aromatisering til østrogener, men kan også forstærke aromatiseringen ved lave koncentrationer. Når androgenniveauerne stiger, vælger præantrale granulosaceller fortrinsvis ikke aromatiseringsvejen til østrogener, men den enklere androgenvej via 5a-reduktase for at omdanne til et androgen, der ikke kan omdannes til østrogen, hvorved aromataseaktiviteten hæmmes. Denne proces hæmmer også dannelsen af FSH- og LH-receptorer og stopper dermed follikeludviklingen.
Aromatiseringsprocessen, folliklen med høje androgenniveauer gennemgår atresiprocesser. Folliklens vækst og udvikling afhænger af dens evne til at omdanne androgener til østrogener.
I nærvær af FSH vil det dominerende stof i follikulærvæsken være østrogener. I fravær af FSH - androgener. LH er normalt fraværende i follikulærvæsken indtil midten af cyklussen. Så snart LH-niveauet stiger, falder den mitotiske aktivitet i granulosacellerne, degenerative forandringer opstår, og androgenniveauet i folliklen stiger. Niveauet af steroider i follikulærvæsken er højere end i plasma og afspejler den funktionelle aktivitet i ovariecellerne: granulosa- og thecaceller. Hvis det eneste mål for FSH er granulosaceller, har LH mange mål - thecaceller, stromale og luteinceller samt granulosaceller. Både granulosa- og thecaceller har evnen til steroidogenese, men aromataseaktivitet dominerer i granulosaceller.
Som reaktion på LH producerer thecaceller androgener, som derefter omdannes af granulosaceller til østrogener gennem FSH-induceret aromatisering.
Efterhånden som folliklen vokser, begynder thecacellerne at udtrykke gener for LH-receptorer, P450 sec og 3beta-hydroxysteroid dehydrogenase. Insulinlignende vækstfaktor (IGF-1) øger synergistisk med LH genekspressionen, men stimulerer ikke steroidogenese.
Ovariel steroidogenese er altid LH-afhængig. Efterhånden som folliklen vokser, udtrykker thecacellerne enzymet P450c17, som danner androgener fra kolesterol. Granulosaceller har ikke dette enzym og er afhængige af thecaceller for at producere østrogener fra androgener. I modsætning til steroidogenese er follikulogenese FSH-afhængig. Efterhånden som folliklen vokser, og østrogenniveauerne stiger, aktiveres en feedbackmekanisme - FSH-produktionen hæmmes, hvilket igen fører til et fald i folliklens aromataseaktivitet og i sidste ende til follikulær atresi gennem apoptose (programmeret celledød).
Feedbackmekanismen for østrogener og FSH hæmmer udviklingen af follikler, der er begyndt at vokse, men ikke den dominerende follikel. Den dominerende follikel indeholder flere FSH-receptorer, som understøtter proliferationen af granulosaceller og aromatiseringen af androgener til østrogener. Derudover fungerer de parakrine og autokrine signalveje som en vigtig koordinator for udviklingen af den antrale follikel.
Den autokrine/parakrine regulator består af peptider (inhibin, activin, follistatin), som syntetiseres af granulosaceller som reaktion på FSH og trænger ind i follikulærvæsken. Inhibin reducerer FSH-sekretion; activin stimulerer frigivelsen af FSH fra hypofysen og forstærker FSH's virkning i æggestokkene; follistatin undertrykker FSH-aktivitet, muligvis ved at binde activin. Efter ægløsning og udvikling af corpus luteum er inhibin under kontrol af LH.
Væksten og differentieringen af ovarieceller påvirkes af insulinlignende vækstfaktorer (IGE). IGF-1 virker på granulosaceller og forårsager en stigning i cyklisk adenosinmonofosfat (cAMP), progesteron, oxytocin, proteoglycan og inhibin.
IGF-1 virker på thecacellerne og forårsager øget androgenproduktion. Thecacellerne producerer til gengæld tumornekrosefaktor (TNF) og epidermal vækstfaktor (EGF), som også reguleres af FSH.
EGF stimulerer proliferationen af granulosaceller. IGF-2 er den primære vækstfaktor i follikelvæske, og IGF-1, TNF-α, TNF-3 og EGF findes også i den.
Forstyrrelse af parakrin og/eller autokrin regulering af ovariefunktionen synes at spille en rolle i ægløsningsforstyrrelser og i udviklingen af polycystiske ovarier.
Efterhånden som den antrale follikel vokser, stiger østrogenindholdet i follikulærvæsken. Ved deres højdepunkt optræder LH-receptorer på granulosacellerne, luteinisering af granulosacellerne finder sted, og progesteronproduktionen stiger. I den præovulatoriske periode forårsager en stigning i østrogenproduktionen således forekomsten af LH-receptorer, som igen forårsager luteinisering af granulosacellerne og progesteronproduktionen. En stigning i progesteron reducerer østrogenniveauet, hvilket tilsyneladende forårsager en anden top af FSH midt i cyklussen.
Ægløsning menes at forekomme 10-12 timer efter LH-toppen og 24-36 timer efter østradiol-toppen. LH menes at stimulere reduktion af oocyttens deling, luteinisering af granulosaceller og syntese af progesteron og prostaglandin i folliklen.
Progesteron forstærker aktiviteten af proteolytiske enzymer, som sammen med prostaglandin deltager i rupturen af follikelvæggen. Den progesteron-inducerede top af FSH tillader oocytten at forlade folliklen ved at omdanne plasminogen til det proteolytiske enzym plasmin og giver et tilstrækkeligt antal LH-receptorer til normal udvikling af lutealfasen.
Inden for 3 dage efter ægløsning øges granulosacellerne i størrelse, og karakteristiske vakuoler fyldt med pigmentet lutein fremkommer i dem. Theca-luteale celler differentierer sig fra theca og stroma og bliver en del af corpus luteum. Kapillærer, der trænger ind i corpus luteum, udvikles meget hurtigt under påvirkning af angiogenesefaktorer, og med forbedret vaskularisering øges produktionen af progesteron og østrogener. Aktiviteten af steroidogenese og corpus luteums levetid bestemmes af niveauet af LH. Corpus luteum er ikke en homogen cellulær formation. Ud over 2 typer luteale celler indeholder det endotelceller, makrofager, fibroblaster osv. Store luteale celler producerer peptider (relaxin, oxytocin) og er mere aktive i steroidogenese med større aromataseaktivitet og større syntese af progesteron end små celler.
Progesteronets topniveau indtræffer på den 8. dag efter LH-toppen. Det bemærkes, at progesteron og østradiol udskilles episodisk i lutealfasen i korrelation med den pulserende output af LH. Med dannelsen af corpus luteum overgår kontrollen over inhibinproduktionen fra FSH til LH. Inhibin stiger med stigningen i østradiol før LH-toppen og fortsætter med at stige efter LH-toppen, selvom østrogenniveauerne falder. Selvom inhibin og østradiol udskilles af granulosaceller, reguleres de af forskellige veje. Faldet i inhibin ved slutningen af lutealfasen bidrager til stigningen i FSH i den næste cyklus.
Det gule legeme aftager meget hurtigt - på den 9.-11. dag efter ægløsning.
Mekanismen for degeneration er uklar og er ikke relateret til østrogeners luteolytiske rolle eller til en receptorrelateret mekanisme, som observeret i endometriet. Der er en anden forklaring på østrogeners rolle produceret af corpus luteum. Det er kendt, at østrogener er nødvendige for syntesen af progesteronreceptorer i endometriet. Lutealfaseøstrogener er sandsynligvis nødvendige for progesteronrelaterede ændringer i endometriet efter ægløsning. Utilstrækkelig udvikling af progesteronreceptorer, som følge af utilstrækkelige østrogenniveauer, er muligvis en yderligere mekanisme for infertilitet og tidlige graviditetstab, en anden form for lutealfasedefekt. Det menes, at corpus luteums levetid etableres på tidspunktet for ægløsning. Og det vil helt sikkert gå i tilbagegang, hvis det ikke understøttes af humant choriongonadotropin på grund af graviditet. Således fører regression af corpus luteum til et fald i niveauerne af østradiol, progesteron og inhibin. Et fald i inhibin fjerner dets undertrykkende effekt på FSH; Et fald i østradiol og progesteron muliggør en meget hurtig genoprettelse af GnRH-sekretion og fjernelse af feedbackmekanismen fra hypofysen. Et fald i inhibin og østradiol, sammen med en stigning i GnRH, giver anledning til FSH frem for LH. En stigning i FSH fører til follikelvækst med efterfølgende selektion af en dominant follikel, og en ny cyklus begynder, hvis graviditet ikke finder sted. Steroidhormoner spiller en ledende rolle i reproduktionsbiologi og generel fysiologi. De bestemmer den menneskelige fænotype, påvirker det kardiovaskulære system, knoglemetabolismen, huden, den generelle trivsel og spiller en nøglerolle i graviditet. Steroidhormonernes virkning afspejler de intracellulære og genetiske mekanismer, der er nødvendige for at transmittere et ekstracellulært signal til cellekernen for at forårsage en fysiologisk reaktion.
Østrogener trænger diffust ind i cellemembranen og binder sig til receptorer i cellekernen. Receptor-steroidkomplekset binder sig derefter til DNA. I målcellerne fører disse interaktioner til genekspression, proteinsyntese og specifik celle- og vævsfunktion.
Использованная литература


 [
[